표적치료제를 위한 항체 결합 크리스퍼 나노복합체 개발
생체 내 전신 투여 통한 유전자교정 치료 및 다양한 암종에 적용 가능한 플랫폼 기술로 기대
[바이오타임즈] 단 한 번의 투여로 난치성 질환을 근본적으로 치료할 수 있다고 알려져 ‘꿈의 치료제’로 불리는 유전자 치료제 대한 관심이 높아지고 있다.
이에 최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 특히 지난해 12월 미국 식품의약국(FDA)는 중증 겸상적혈구 빈혈 환자가 크리스퍼 유전자 가위 치료제 ‘카스게비(Casgevy)’를 사용할 수 있도록 승인하면서, 크리스퍼(CRISPR) 연구개발 경쟁이 본격화되고 있다.
카스게비는 ‘캐스9’이라는 효소를 사용해 마치 가위질하듯이 유전자의 특정 염기를 선택적으로 제거하는 것으로, 암과 에이즈 바이러스(HIV) 등 치료에도 활용할 가능성이 있는 것으로 알려졌다.
기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
◇KAIST 정현정 교수팀, 크리스퍼 단백질과 항체 결합해 암세포 특이적 전달&항암 효능 확인
이러한 가운데, KAIS 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
KAIST 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 ‘어드밴스드 사이언스(Advanced Science)’에 3월 29일 온라인 게재됐다.(논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
3세대 유전자 가위로 불리는 크리스퍼 기술은 유전정보를 전달하는 복사본인 RNA를 길라잡이 삼아서 Cas9이라는 효소(단백질)가 특정 DNA 염기 서열과 결합하도록 만든 뒤 원하는 돌연변이 염기를 잘라내는 원리다.
1세대 징크핑거와 2세대 탈렌과는 달리 복잡한 단백질 구조가 없고 DNA 절단 정도가 더욱 정교하다. 이에 설계가 간편하고 제작비용이 적게 들며, 정교하고 효율적인 유전자 편집 가능해 현재 유전자 편집 시장의 50% 이상을 차지한다.
하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타깃 이펙트(Off-Target Effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
무엇보다 크리스퍼 단백질은 분자량이 커서 바이러스(AAV) 전달체를 이용한 체내 전달에 어려움이 있어 유전자 치료제로서의 활용도가 극히 제한적이었다. 효율적인 체내 유전자교정 치료를 위해서는 유전자 가위를 원하는 곳으로 전달하는 것이 필수적이다. 치료가 필요한 다양한 조직으로 보내기 위해서는 현재까지 아데노연관바이러스(AAV)를 이용하는 것이 최선의 방법인데, AAV가 전달할 수 있는 유전자의 크기가 4.7 kb로 제한되어 있어 크기가 큰 크리스퍼 기술은 가장 대중적인 기술임에도 유전자 치료제로서 한계가 있다.
이 밖에도 세포독성 문제도 지적돼왔다.

◇생체 내 전신 투여 통한 유전자교정 치료 및 다양한 암종에 적용 가능한 플랫폼 기술로 기대
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체 분자를 더 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다.
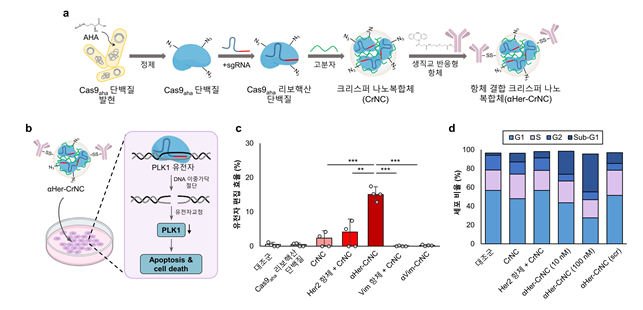
연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(Tumor Antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1 유전자 교정을 통해 높은 항암 효과가 나타남을 확인했다.
PLK1(polo-like kinase)은 세포 분열을 조절하는 인산화효소로, 암세포 분열과 관련이 깊다고 알려져 있다. 이번 연구에서는 PLK1 유전자를 표적해 암세포 분열을 억제하여 항암 효과를 유도했다.
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
[바이오타임즈=김수진 기자] sjkimcap@biotimes.co.kr


